- Зохиолч Alex Aldridge [email protected].
- Public 2023-12-17 13:45.
- Хамгийн сүүлд өөрчлөгдсөн 2025-06-01 07:37.
Гол ялгаа - Хүчтэй Лиганд ба Сул Лиганд
Лиганд нь төв атом эсвэл ионтой координатын ковалент холбоогоор дамжуулан хоёр электроноо өгдөг атом, ион эсвэл молекул юм. Лигандын тухай ойлголтыг химийн зохицуулалтын хүрээнд авч үздэг. Лиганд нь металлын ионуудтай нэгдэл үүсгэхэд оролцдог химийн зүйл юм. Тиймээс тэдгээрийг нарийн төвөгтэй бодис гэж нэрлэдэг. Лиганд нь лигандын нягтралаас хамааран монодентат, хоёр шүдтэй, гурвалсан гэх мэт байж болно. Шүдний чанар гэдэг нь лиганд байгаа донорын бүлгийн тоо юм. Монодентат гэдэг нь лиганд зөвхөн нэг донорын бүлэгтэй гэсэн үг юм. Bidentate гэдэг нь нэг лиган молекул тутамд хоёр донорын бүлэгтэй гэсэн үг. Кристал талбайн онол дээр үндэслэн ангилсан хоёр үндсэн төрлийн лиганд байдаг; хүчтэй лигандууд (эсвэл хүчтэй талбайн лигандууд) ба сул лигандууд (эсвэл сул талбайн лигандууд). Хүчтэй лиганд ба сул лигандын хоорондох гол ялгаа нь хүчтэй талбарын лигандтай холбогдсоны дараа орбиталууд хуваагдах нь дээд ба доод энергийн түвшний орбиталуудын хооронд илүү их ялгаа үүсгэдэг бол сул талбарын лигандтай холбогдсоны дараа орбиталууд хуваагдах нь бага ялгаа үүсгэдэг. дээд ба доод энергийн түвшний орбиталуудын хооронд.
Болор талбайн онол гэж юу вэ?
Кристалын талбайн онолыг хүрээлэн буй орчноос үүсгэсэн статик цахилгаан орны нөлөөгөөр электрон орбиталуудын (ихэвчлэн d эсвэл f орбитал) доройтлыг (ижил энергитэй электрон бүрхүүл) задлахыг тайлбарлах загвар гэж тодорхойлж болно. анион эсвэл анионууд (эсвэл лигандууд). Энэ онолыг ихэвчлэн шилжилтийн металлын ионы цогцолборуудын зан төлөвийг харуулахад ашигладаг. Энэ онол нь соронзон шинж чанар, зохицуулалтын цогцолборуудын өнгө, гидратацийн энтальпи гэх мэтийг тайлбарлаж чаддаг.
Оноол:
Металл ион ба лигандын харилцан үйлчлэл нь эерэг цэнэгтэй металлын ион ба лигандын хосгүй электронуудын сөрөг цэнэгийн таталцлын үр дүн юм. Энэ онол нь үндсэндээ доройтсон таван электрон тойрог замд (металл атом нь таван d орбиталтай) тохиолддог өөрчлөлтүүд дээр суурилдаг. Лиганд металлын ионтой ойртох үед хослогдоогүй электронууд нь металл ионы бусад d орбиталуудтай харьцуулахад зарим d орбитальтай ойр байдаг. Энэ нь доройтлын алдагдалд хүргэдэг. Мөн d орбитал дахь электронууд нь лигандын электронуудыг түлхэж байдаг (учир нь хоёулаа сөрөг цэнэгтэй). Иймээс лигандтай ойр байдаг d орбиталууд бусад d орбиталуудаас өндөр энергитэй байдаг. Үүний үр дүнд d орбиталууд энергид тулгуурлан өндөр энергитэй d орбитал ба бага энергитэй d орбиталууд болж хуваагдана.
Энэ хуваагдалд нөлөөлж буй зарим хүчин зүйлүүд; металлын ионы мөн чанар, металлын ионы исэлдэлтийн төлөв, төв металлын ионы эргэн тойрон дахь лигандын зохион байгуулалт, лигандын мөн чанар. Эдгээр d орбиталуудыг энергид тулгуурлан хуваасны дараа их ба бага энергийн d орбиталуудын хоорондын ялгааг болор талбарын хуваагдлын параметр гэж нэрлэдэг (октаэдр цогцолборын хувьд ∆oct).
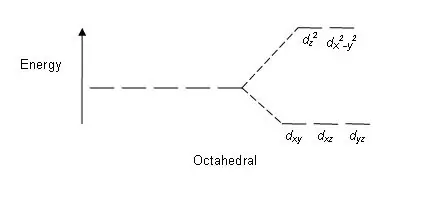
Зураг 01: Октаэдр цогцолбор дахь хуваах загвар
Хуваах загвар: Таван d орбиталь байдаг тул хуваагдал 2:3 харьцаатай явагдана. Октаэдр цогцолборт хоёр тойрог зам нь өндөр энергийн түвшинд (хамтдаа "жишээ нь" гэж нэрлэдэг), гурван тойрог зам нь доод энергийн түвшинд (хамтдаа t2g гэгддэг) байдаг. Тетраэдр цогцолборт эсрэгээрээ тохиолддог; гурван орбитал нь эрчим хүчний өндөр түвшинд, хоёр нь доод энергийн түвшинд байна.
Хүчтэй Лиганд гэж юу вэ?
Хүчтэй лиганд эсвэл хүчтэй талбарын лиганд нь илүү өндөр талст талбайн хуваагдалд хүргэдэг лиганд юм. Энэ нь хүчтэй талбайн лигандыг холбох нь энергийн дээд ба доод түвшний орбиталуудын хооронд илүү их ялгаа үүсгэдэг гэсэн үг юм. Жишээ нь: CN- (цианидын лиганд), NO2- (нитро лиганд) болон CO (карбонил) лигандууд).
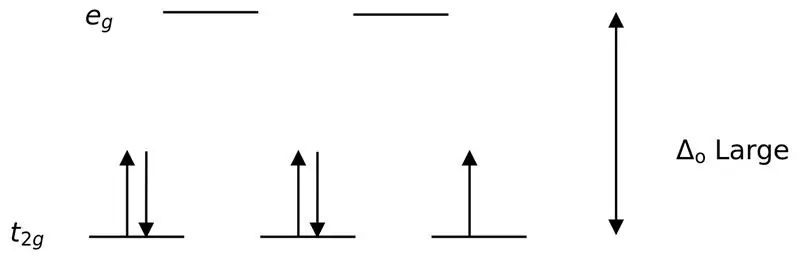
Зураг 02: Бага эргүүлэх хуваалт
Эдгээр лигандуудтай комплекс үүсэхэд эхлээд бага энергийн орбиталууд (t2g) бусад өндөр энергийн түвшний орбиталуудыг дүүргэхийн өмнө электроноор бүрэн дүүрдэг (жишээ нь). Ийм байдлаар үүссэн цогцолборуудыг "бага эргэлтийн цогцолбор" гэж нэрлэдэг.
Сул Лиганд гэж юу вэ?
Сул лиганд эсвэл сул талбарын лиганд нь доод талст талбарыг задлахад хүргэдэг лиганд юм. Энэ нь сул талбарын лигандыг холбосноор энергийн дээд ба доод түвшний орбиталуудын хоорондын ялгаа бага байна гэсэн үг.
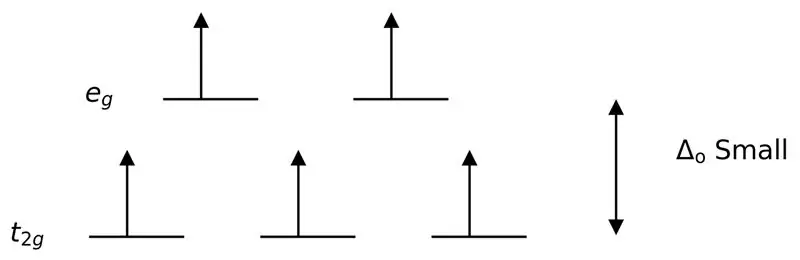
Зураг 3: Өндөр эргэлтийн хуваалт
Энэ тохиолдолд хоёр тойрог замын түвшний хоорондох бага ялгаа нь эдгээр энергийн түвшний электронуудын хооронд түлхэлт үүсгэдэг тул бага энергитэй орбиталуудтай харьцуулахад өндөр энергитэй орбиталууд электроноор амархан дүүрдэг. Эдгээр лигандуудтай үүсгэгдсэн цогцолборуудыг "өндөр эргэлттэй цогцолбор" гэж нэрлэдэг. Сул талбарын лигандуудын жишээнд I- (иодидын лиганд), Br- (бромидын лиганд) гэх мэт орно.
Хүчтэй лиганд ба сул лиганд хоёрын ялгаа юу вэ?
Хүчтэй Лиганд ба Сул Лиганд |
|
| Хүчтэй лиганд эсвэл хүчтэй талбарын лиганд нь илүү өндөр талст талбар хуваагдахад хүргэдэг лиганд юм. | Сул лиганд эсвэл сул талбарын лиганд нь доод талст талбар хуваагдахад хүргэдэг лиганд юм. |
| Онол | |
| Хүчтэй талбарын лигандыг холбосны дараа хуваагдах нь энергийн дээд ба доод түвшний орбиталуудын хооронд илүү их ялгаа үүсгэдэг. | Сул талбарын лигандыг холбосны дараа орбиталууд хуваагдах нь дээд ба доод энергийн түвшний орбиталуудын хооронд бага ялгаа үүсгэдэг. |
| Ангилал | |
| Хүчтэй хээрийн лигандуудаар үүсгэгдсэн цогцолборуудыг "бага эргэлттэй комплекс" гэж нэрлэдэг. | Сул талбарын лигандуудаар үүсгэгдсэн цогцолборуудыг "өндөр эргэлттэй комплекс" гэж нэрлэдэг. |
Тойм - Хүчтэй Лиганд ба Сул Лиганд
Хүчтэй лиганд ба сул лиганд нь металл ионы d орбиталыг энергийн хоёр түвшинд хуваахад хүргэдэг анион буюу молекулууд юм. Хүчтэй лиганд ба сул лигандын хоорондох ялгаа нь хүчтэй талбарын лигандыг холбосны дараа хуваагдах нь дээд ба доод энергийн түвшний орбиталуудын хооронд илүү их ялгаа үүсгэдэг бол сул талбарын лигандыг холбосны дараа орбиталуудын хуваагдал нь дээд ба доод хоорондын ялгаа багатай байдагт оршино. энергийн түвшний орбиталууд.






